

Eine der Methoden öffnet mit scharfen Glasnadeln die Zona pellucida, die tangential durchstochen und aufgebrochen wird. Die Methode wirkt ein wenig brachial und erfordert viel Übung. Der Embryologe muß dabei sehr aufpassen, dass er mit den scharfen Nadeln nur die Eizellenhülle aufbricht und nicht Zellen des Embryo verletzt. Die sehr dünnen, nur wenige Mikrometer, also tausendstel Millimeter starken Glasnadeln sind sehr fragil und können leicht zerbrechen.
Bei einer anderen Methode wird mit einer dünnen Gaskapillare saure Tyrode-Lösung an die Eizellenhülle gespült. Den Namen hat diese Säure von Maurice V. Tyrode, einem 1878 in Besancon, Frankreich geborenen Pharmakologen. Diese Säure ätzt die Zona pellucida weg, so dass ein Loch entsteht. Der Embryologe muß aber sehr gut aufpassen. Dauert die Spülung nur einen Wimpernschlag zu lange, dann wird nicht nur die Eizellenhülle angegriffen, sondern auch die dahinter liegenden Zellen des Embryo, wenn die Eizellenhüllen schon weg geätzt ist und die Säure den dann ungeschützten Embryo angreifen kann. Die Zellen des Embryo würden das nicht überleben.
Die Methode muß sehr gut geübt sein und darf nur von einem echten Könner angewendet werden.
Die dritte und heute am weitesten verbreitete Methode ist die Eröffnung mit einem Laser.
Laser ist ein sogenanntes Akronym, das heißt eine Bezeichnung die aus mehreren Anfangsbuchstaben zusammengesetzt wird. Dieses Akronym kommt aus der englischen Sprache und steht für Light Amplification by Stimulation Emission of Radiation (auf deutsch Lichtverstärkung durch stimulierte Emission von Strahlung).
Kurz gesagt handelt es sich dabei um sehr energiereiches Licht, welches geeignet ist, Materie zu verdampfen. Es hat den Vorteil, dass die Wirkung der Energie sehr gezielt auf wenige Mikrometer begrenzt angewendet werden kann, ohne dass die ganze Umgebung mit verdampft wird.
Das kann beim Schneiden von Stahl genauso eingesetzt werden wir bei chirurgischen Operationen. Und eben auch beim Verdampfen der Eizellenhülle. Unter dem Mikroskop kann man die richtige Stelle für die Verdampfung einstellen. Mit einem winzig kurzen Impuls von wenigen Millisekunden (tausendstel Sekunden) wird der Lichtstrahl auf die Zona pellucida gerichtet und hinterlässt ein kleines Loch, ohne die Umgebung und die dahinter liegenden Zellen des Embryo zu zerstören.
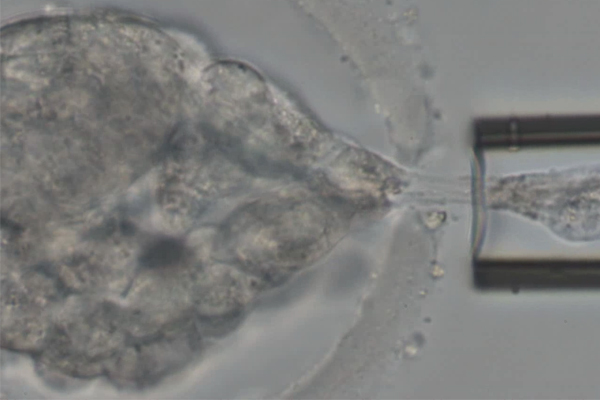
Nun ist der weg frei für die Saugpipette, um in die Eizellenhülle einzudringen, und ein oder mehrere Zellen des Embryo zu entnehmen.
Das erste Stadium nennt man Furchungsstadium, in dem die Zellen des Embryo, die sogenannten Blastomere noch relativ groß und einzeln unter dem Mikroskop erkennbar sind. Dies ist bis zum Tag 3 nach der Befruchtung der Eizelle der Fall. In diesem Stadium hat der Embryo meist 6 bis 16 Zellen, von denen eine bis zwei Zellen entnommen werden.
Das andere Stadium ist das Blastozystenstadium. Hier sind die Zellen schon so klein und so eng zusammen gerückt, dass sie einzeln auch unter einem Mikroskop mit sehr hoher Vergrößerung nicht mehr zu erkennen sind. Eine Blastozyste weist zwischen Tag fünf und Tag 7 nach der Befruchtung im Mittel zwischen 50 und 150 Zellen auf. Wenn hier Zellen abgesaugt werden, kann der Embryologe nicht mehr steuern ob er 5, 10 oder 15 Zellen absaugt. In wissenschaftlichen Untersuchungen wurde aber gezeigt, dass der Embryo den Verlust von mehr als 20 Zellen ohne Schaden ausgleichen kann.
Die gewonnen Zellen werden dann einer entsprechenden genetischen Untersuchung zugeführt.
Wie die FISH – Diagnostik funktioniert wurde bereits in dem Abschnitt über die Polkörperdiagnostik beschrieben. Nur werden an embryonalen nicht einzelne Chromatiden gesucht, sondern Chromosomenabschnitt nachgewiesen, welche in der untersuchten Zelle in richtiger Anzahl, oder vermindert oder vermehrt vorkommen.
Bei der array CGH handelt es sich quasi um eine Umkehrung der FISH – Diagnostik.
Auf einem Objektträger werden die Sonden aufgetragen. Dabei werden die Sonden, welche die verschiedenen Chromosomenabschnitte anzeigen, in sehr vielen verschiedenen Spot (Flecken) aufgetragen.
Dann werden die zu untersuchende DNA aus den embryonalen Zellen und die DNA einer gesunden Person mit den Farbstoffen grün und rot markiert und auf den Objektträger gegeben. Wenn die Test-DNA und die Kontroll-DNA in gleichem Verhältnis vorhanden sind, werden sie sich auch in gleichem Verhältnis an die Sonden auf dem entsprechenden Spot auf dem Objektträger binden. Dieser Spot leuchtet dann gelb. Ist an einem Spot zuviel Test-DNA gebunden leuchtet der Spot grün, ist zu wenig Test-DNA vorhanden leuchtet der Spot rot.
Das es hunderte bis tausende von Spots auf einem solchen Objektträger geben kann, erfolgt die Auswertung durch einen Computer gestützt. Der Computer ordnet dann alle Spots den verschiedenen Chromosomen zu und stellt die Farbausprägungen graphisch dar. So kann der Untersucher am Ende erkennen, ob ein ganzes Chomosom oder ein Bruchstück eines Chromosoms zu viel oder zu wenig in der untersuchten Erbsubstanz enthalten ist. Je nach Ergebnis kann der Embryo dann übertragen werden oder auch nicht.
Bei der PCR wird die Erbsubstanz, die als Doppelhelix, die man sich wie eine verdrehte Strickleiter vorstellen kann, durch Hitzeeinwirkung aufgebrochen. Nun liegen die beiden Seiten der Strickleiter getrennt voneinander vor und die Erbsubstanz ist sozusagen geöffnet. Nun ist sie für die Vermehrung zugänglich. Durch ein Eiweißenzym, die DNA-Polymerase wird in einem ersten Schritt die Erbsubstanz DNA aus den zu untersuchenden Zellen vermehrt, denn die Menge ist viel zu gering , um sofort die Diagnostik zu beginnen. Diesen Prozeß nennt man Amplifikation. Es soll natürlich nicht die gesamte Erbsubstanz vermehrt werden, das wäre ja viel zu viel Material. Durch die Wahl der Primer kann man den Abschnitt der zu vermehrenden Erbsubstanz recht gut eingrenzen. Da wir in der Erbsubstanz immer zwei Genorte ( Allele ) für ein bestimmtes Eiweiß, eines von der Mutter und eines vom Vater haben, ist es von großer grundsätzlicher Bedeutung, dass bei der Amplifikation beide Genorte vermehrt werden. Oft geschieht dies aber nicht, es tritt ein sogenannter allel drop-out, also der Asufall eines Genorts in dem vermehrten Untersuchungsmaterial auf. Würde nun die Diagnostik fortgesetzt, könnte es sein, dass nur ein gesunder Genort nachgewiesen und der kranke Genort gar nicht entdeckt wird. Dann würde in Embryo für gesund erklärt, obwohl er es gar nicht ist.
Um dieses Phänomen des allel drop-out zu kontrollieren, müssen neben den Genorten sogenannte Markerregionen bestimmt werden. Diese Markerregionen sind Abschnitte in der Erbsubstanz, die keine Informationen für die Bildung bestimmter Eiweiße tragen, aber gleichzeitig hoch spezifisch für das Individuum sind. Auf diesen Markerregionen beruhen zum Beispiel Abstammungsuntersuchungen oder DNA-Tests in der Kriminologie.
Wenn die entsprechenden Markerregionen von Mutter und Vater nachgewiesen werden können, ist gesichert, dass auch die Genorte von Mutter und Vater vermehrt wurden.
Die vermehrte Erbsubstanz wird dann auf mit einem speziellen Gel beschichtete Objektträger aufgetragen dun einem elektrischen Feld ausgesetzt. Diesen Vorgang nennt man Gelelektrophorese. Da die Erbsubstanz in dem elektrischen Feld je nach Beschaffenheit verschieden schnell wandert, werden sich auf dem Objektträger verschiedene Banden ausbilden. Diese können dann ausgewertet werden.
Mit der PCR – Technik können die verschiedensten monogen vererbten Erkrankungen, wie z.B. Muskelschwund oder Zerfall der Hirnzellen, bei denen einzelne Gene verändert sind, diagnostizieren. In der Regel ist nur ein einziger Baustein der Erbsubstanz verändert, doch das genügt schon, dass ein falsches Eiweiß gebildet wind, welches seine Funktion nicht erfüllen kann. Der ganze Organismus nimmt dann Schaden wegen der Fehlfunktion eines einzigen Eiweißes.
Anlass der Stellungnahme: 1989 wurde erstmals die Präimplantationsdiagnostik (PID) zur genetischen Untersuchung künstlich befruchteter Embryonen noch vor der Übertragung in den Uterus durchgeführt. Seit Mitte der 1990er-Jahre wird in Deutschland über die Verantwortbarkeit und den angemessenen rechtlichen Rahmen für PID in Politik, Gesellschaft und Öffentlichkeit kontrovers diskutiert. Dazu hat auch die Anwendung der PID in vielen europäischen Nachbarstaaten beigetragen. Das Embryonenschutzgesetz (ESchG) von 1990 erwähnt die PID nicht.2 § 4 Abs. 2 Nr. 1 des Stammzellgesetzes (StZG) von 2002 bezieht sich implizit auf die PID, allerdings nicht auf die Zulässigkeit der PID in Deutschland. Bisher wurde die PID überwiegend als mit dem Embryonenschutzgesetz nicht vereinbar angesehen. Mit einem Urteil vom 6. Juli 2010 hat jedoch der Bundesgerichtshof (BGH) entschieden, dass eine nach extrakorporaler Befruchtung durchgeführte PID mittels Blastozystenbiopsie und anschließender Untersuchung der entnommenen pluripotenten Trophoblastzellen auf schwere genetische Schäden keine Strafbarkeit nach dem Embryonenschutzgesetz, insbesondere nicht nach dessen § 1 Abs. 1 Nr. 2 und § 2 Abs. 1 begründe.5 Entschieden wurde über zwei Fälle, in denen zwei bzw. drei Embryonen mittels Blastozystenbiopsie untersucht worden waren. Das Urteil entfaltet Rechtskraft nur für die konkret entschiedenen Fälle. Jedoch ist davon auszugehen, dass Praxis und Gerichte den Rechtsausführungen folgen werden. Das Urteil will die 1 Es ging in den ersten Fällen um die Diagnose des Geschlechts aufgrund eines Risikos für geschlechtsgebundene Erbkrankheiten wie Adrenoleukodystrophie und x-gebundene mentale Retardierung (vgl. Handyside et al. 1990). 2 Gesetz vom 13.12.1990, BGBl I, 2746. 3 Gesetz vom 28.6.2002, BGBl I, 2277. Siehe insbesondere Nationaler Ethikrat 2003, 101 ff. 5 BGH-Urteil vom 6.7.2010 – 5 StR 386/09 (NJW 2010, 2672; NStZ 2010, 579). Grenzen einer nach geltendem Recht nicht verbotenen PID nicht allgemeingültig beantworten. Denn der BGH betont, dass Entscheidungsgegenstand nur die Absicht zur Durchführung der Untersuchung auf bestimmte schwerwiegende genetische Schäden sei, um zu vermeiden, dass ein nicht lebensfähiges oder schwergeschädigtes Kind geboren wird und daraus eine schwerwiegende Beeinträchtigung der Schwangeren sowie eine Konfliktsituation für die Eltern resultiert. Die vom Gericht vorgenommene Interpretation führt nach den Ausführungen des BGH nicht zur Zulässigkeit einer unbegrenzten Selektion von Embryonen anhand genetischer Merkmale, etwa zum Zwecke der nicht krankheitsrelevanten Geschlechtswahl oder für eine gezielte Auswahl von Embryonen mit bestimmten Immunitätsmustern. Ob angesichts der Wertung des – auf die PID nicht anwendbaren – § 15 Abs. 2 des Gendiagnostikgesetzes (GenDG) das Gleiche für die Absicht gelte, genetische Eigenschaften des Embryos für eine Erkrankung festzustellen, die nach dem Stand der medizinischen Wissenschaft und Technik erst nach Vollendung des 18. Lebensjahres ausbricht, habe er nicht entscheiden müssen, so der BGH. Zugleich stellt der BGH klar, dass eine PID an totipotenten Zellen in § 2 Abs. 1 und § 6 Abs. 1 ESchG, jeweils in Verbindung mit § 8 Abs. 1 ESchG, eindeutig untersagt und mit Strafe bedroht ist. Der BGH geht davon aus, dass zwischen einem Verbot der PID und dem geltenden Recht des Schwangerschaftsabbruchs ein Wertungswiderspruch besteht. Ob ein solcher Wertungswiderspruch besteht, gehört zu den in diesem Zusammenhang umstrittenen Fragen. Die Entscheidung des BGH ist für den Gesetzgeber – im Gegensatz zu einer Entscheidung des Bundesverfassungsgerichts – nicht bindend. Vielen Gruppen in der Gesellschaft ist nun an einer schnellen Klärung der Rechtslage gelegen. Der Deutsche Ethikrat belässt es nicht bei einem Hinweis auf die im Jahre 2002 und 2003 veröffentlichten Empfehlungen der Enquete-Kommission des Deutschen Bundestages „Recht und Ethik der modernen Medizin“ und des Nationalen 9 Ethikrates zur Präimplantationsdiagnostik6 , sondern legt im Hinblick auf die bevorstehenden parlamentarischen Beratungen unter Berücksichtigung inzwischen eingetretener Entwicklungen und Erkenntnisse zum Thema PID eine eigene Stellungnahme vor.
© 2011 Deutscher Ethikrat, Berlin Alle Rechte vorbehalten. Eine Abdruckgenehmigung wird auf Anfrage gern erteilt. Hamburg ISBN 978-3-941957-19-0
Am 7. Juli 2011 hat der Bundestag schließlich - nach langem Ringen - das Präimplantationsgesetz beschlossen, welches die Einführung eines neuen § 3a ESchG nach sich zog.
PräimpG, BT-Drs. 17/5452
PräimpG, BT-Drs. 17/6400
Am 8. Dezember 2011 tritt das Gesetz in Kraft.
Bundesgesetzblatt Jahrgang 2011 Teil I Nr. 58
Am 1.Februar 2014 tritt die vom Bundestag verfasste und vom Bundesrat verabschiedete PID Verordnung (PIDV) in Kraft.
Gesetz zum Schutz von Embryonen
Bundesgesetzblatt Jahrgang 2013 Teil I Nr. 9
In den folgenden Jahren wird die Verordnung in den einzelnen Bundesländern umgesetzt und am 10.12.2015 ein erster Bericht der Bundesregierung über die Erfahrungen mit der Präimplantationsdiagnostik veröffentlicht.
Ein Jahr Präimplantationsdiagnostik in Deutschland – Erfahrungen aus den PID-Zentren Lübeck und Hamburg